INTRODUCCIÓN
No es aceptable que actualmente los profesionales de la
salud dental ignoren o minimicen la educación y mantenimiento
de la higiene en implantología. La educación
se debe englobar en el marco de todo el conjunto del tratamiento
implanto-protésico como una fase más, y, de
forma constante, mediante mantenimientos periódicos
e individualizados para cada paciente.
La omisión o minimización de estos mantenimientos
puede aumentar los problemas y lesiones derivados de los cambios
de la flora bacteriana de la cavidad oral en las estructuras
periimplantarías (Figura 1).
Información
Una vez que al paciente se le han colocado todas las estructuras
implantarias es fundamental que le hagamos comprender la importancia
del cuidado de su higiene trasladándole cómo debe
realizarla cuando y porqué y las consecuencias negativas
de una nula o incorrecta realización. El odontoestomátologo
y el higienista dental debe de hacer co-partícipe al
paciente implicándole en sus cuidados, en la toma de
decisiones y desarrollando un programa de mantenimiento ajustado
a un protocolo de trabajo general pero con las instrucciones
especificas para cada individuo; de forma que éste se
encuentre más cómodo al sentirse atendido de manera
individualizada y participe de forma más activa (Figuras
2a y 2b)
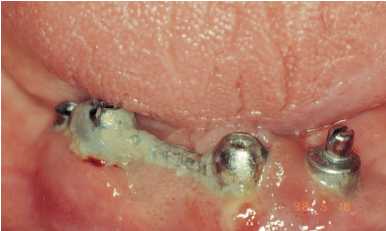
Figura 1. Paciente con acúmulo
de cálculo y placa, bolsas
periimplantarias y movilidad de
los implantes
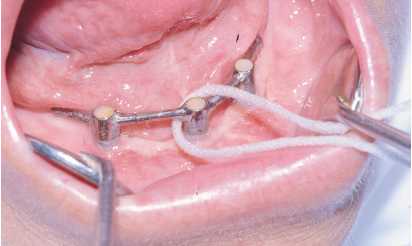
Figuras 2a y 2b. Adiestramiento en la clínica con el
paciente de la utilización de superflos y cepillos interproximales
El paciente es informado a la firma del consentimiento de
la necesidad de los controles periódicos por parte
del profesional para el éxito del tratamiento de
implantes, pero esto puede quedarse sobre el papel firmado
y no ser llevado a cabo si no existe un seguimiento práctico
por parte del paciente y de su control en clínica.
Motivación
"Motivar es dar o explicar la razón o motivo que
se ha tenido para hacer una cosa". En nuestro caso, esa
cosa
ha sido la sustitución de las piezas dentarias perdidas
por implantes. El paciente comienza con una gran ilusión
y esperanza al recuperar sus funciones fonéticas, masticatorias
y estéticas, y en este principio son máximos colaboradores,
pero también la experiencia nos enseña que los
pacientes al recuperar este bienestar poco a poco van confiándose
y se relajan o desatienden su higiene oral y frecuencia de sus
visitas al dentista.
Si previamente hemos proporcionado al paciente la información
del porqué y cuándo debe visitar al dentista,
la siguiente fase es la motivación constante mediante
las visitas en nuestras clínicas y desarrollando
protocolos de trabajo individualizados y en etapas (Ketz,
Macdonall y Stookey, 1979, Pipe y col.,1972):
1. Pequeñas etapas.Proporcionar la información
teórica que el paciente pueda digerir cuando este
haya expresado la necesidad de saber. Por ejemplo, informar
sobre la necesidad de revisiones periódicas y modificación
de hábitos de higiene y dieta.
2. Participación activa: implicar al paciente en
una actividad que estimule el aprendizaje y la retención
de la
información. Por ejemplo, demostrarnos su destreza
con el cepillo dental y corregirle, si fuera necesario.
3. Retroalimentación inmediata: dejar que el paciente
aprenda a evaluar su participación y progresión.
La retroalimentación positiva proporciona apoyo y
estímulo. Por ejemplo, que el paciente vaya reconociendo
sus errores y nos los transmita para corregirlos
4. Establecer un ritmo propio: sintonizar con las necesidades
del paciente. Si el paciente no puede o no quiere
manejar más información no hay que forzar.
Si muestra interés seguir las señales del
paciente. Por ejemplo, si
acude cansado o preocupado, citarle otro día que
esté más relajado; no forzar etapas. De forma
que el dentista o el higienista son los responsables de
explicar al paciente cuándo debe acudir a la clínica
y vigilar que el paciente asista.
Además del contenido esencial tenemos que saber transmitir
el componente motivacional. Este proporcionará
el refuerzo, la necesidad del cambio, el estímulo en
un paciente inmerso en una cultura de bienestar y
cuidado de la salud. Para aquellos que tengan una higiene inadecuada
y caiga en el desánimo o frustración y puedan
remotivarse, deben entender que un hábito correcto de
la higiene bucal es un proceso lento que lleva meses o incluso
años.
Por tanto, es fundamental los controles regulares, la remotivación
para la modificación de los malos hábitos por
aquellos que conducen a una buena salud y mantenimiento de los
tejidos blandos y las estructuras implantarias.
El paciente debe comprobar por sí mismo los resultados
de sus cuidados a través de la higiene y comprender
que cualquier sensación subjetiva debe de informarse
y resolverse en el ámbito de la clínica.
FRECUENCIA DE VISITAS Y PAUTA DE TRABAJO
1.ª visita: A la semana de la colocación de los
implantes y retirada de los puntos quirúrgicos.
Facilitar
al paciente un cepillo de cerdas extra-suaves (quirúrgico)
para la remoción de la placa bacteriana impregnándolo
en gel de clorhexidina durante quince días para acelerar
el proceso de desinflamación de los tejidos
periimplantarios. Si la cicatrización es la correcta,
al mes podemos cambiar el cepillo por uno de cerdas suaves.
2.ª visita: A la semana de la colocación de la prótesis
— Técnicas de higiene.
— Control de placa bacteriana con eritrosina. Enseñamos
al paciente con un espejo, las zonas más susceptibles
de acumulación de placa y mostramos cómo debe
removerse:
1. Con cepillo manual, aconsejamos la Técnica de Bass
modificada o cepillo eléctrico (es importante instruir
al paciente cómo debe colocar el cepillo eléctrico,
ya que en muchos casos este se confía y la remoción
no
se hace desde la encía en dirección al diente
o la prótesis).
2. Cepillos interproximales y/o super floss, enhebradotes.
En pacientes que no se manejen correctamente con estos aditamentos,
es aconsejable los irrigadores para la limpieza interproximal.
— Concretar cita en un mes en la clínica.
3.ª visita: al mes
— Control de higiene y placa bacteriana con reveladores de placa
(eritrosina).
— Revisión de la salud de los tejidos circundantes: posible
inflamación (gingivitis).
— Motivación y refuerzo de la higiene.
— Concretar cita en 3 meses en la clínica.
4.ª visita: a los tres meses
— Control de higiene y placa bacteriana con reveladores de placa
(eritrosina).
— Revisión de la salud de los tejidos circundantes: control
de inflamación
gingival.
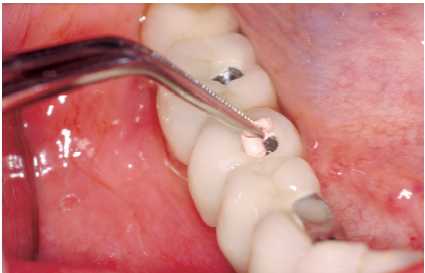
— Eliminación de placa bacteriana y/o cálculo
con curetas de plástico, oro, titanio o carbono composite
(Figura 3), puntas de ultrasonido de carbono composite (Figura
4). No se debe emplear ningún instrumento con punta
metálica, ya que se corre el riesgo de arañar
la superficie del implante y crear nichos en los que proliferen
las bacterias.
— Revisión del ajuste de los tornillos en las prótesis
removibles y el sellado de las troneras en las prótesis
fijas.
— Motivación y refuerzo.
— Concretar cita en 6 meses en la clínica.
5.ª visita: a los seis meses
— Actualización de la historia clínica: posibles
intervenciones quirúrgicas y toma de nuevos fármacos:
anticoagulantes, inmunodepresores, antiepilépticos, antidepresivos,
etc., que puedan tener efectos secundarios en los tejidos blandos
o en la disminución de la saliva.
— Exploración de los tejidos blandos.
— Cambios en el tono, color, contorno, engrosamiento de los
tejidos circundantes a la prótesis, consistencia, sangrado,
supuración, etc.
— Sondaje de las posibles bolsas con sondas de plástico
o de titanio. El sondaje debe realizarse con la presión
adecuada para evitar la rotura del fondo de la bolsa y crear
una bolsa de más profundidad (bolsa falsa) por la destrucción
parcial del sellado epitelial.
En caso de supuración de la bolsa, antes de introducir
la sonda en la siguiente bolsa, esta debe ser reemplazada por
otra estéril para evitar la introducción de gérmenes
en el implante vecino.
— Control de las posibles exposiciones de las espiras del implante.
Valoración del tiempo transcurrido desde la colocación
del implante. Una pérdida ósea durante el primer
año de 1,5 mm se considera que está dentro de
los patrones normales y de 0,1 anual.
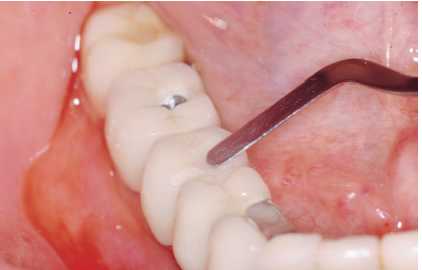
— Limpieza y pulido de la prótesis removible con puntas
de ultrasonido convencionales a intensidad baja y pulido con
pasta de baja abrasividad. En las prótesis atornilladas
o cementadas, limpiamos el margen gingival en contacto con la
funda adyacente con las puntas de ultrasonido a baja intensidad
o curetas de carbono y pulimos con pasta de baja abrasividad
(Figuras 5a y 5b). Comprobamos que el sellado de composite y
gutapercha de cierre de las troneras es correcto.
— Control de la movilidad implantaría con el Perio-test.
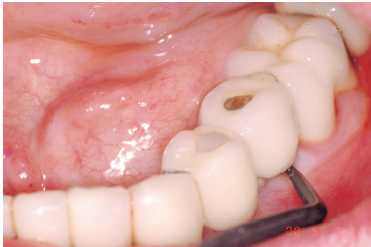
Figura 3. Limpieza de implante con cureta de carbono
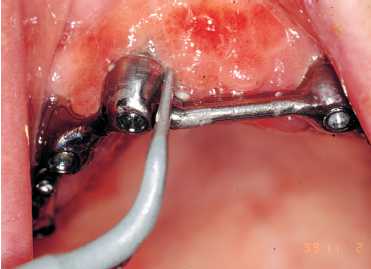
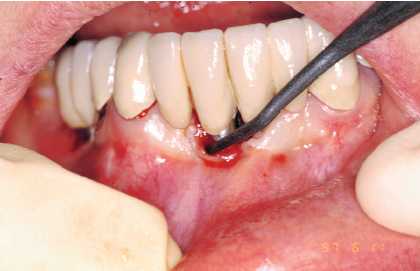
Figura 4. Tratectomía con punta de carbonocomposite

Figuras 5a y 5b. Limpieza de cálculo infragingival y
pulido con pasta de baja agresividad
— Ajuste de pilares y examen oclusal. Apretar los tornillos
que pudieran estar flojos con un torque de 20-35 N/cm. según
fabricante, primero a mano para terminar con la llave de torque
(Figura 6).
— Comprobar la oclusión.
— Motivación y refuerzo.
— Cita en 6 meses con la clínica
Visitas anuales
Comprenden dos visitas realizadas semestralmente en el mismo
año pero con la inclusión de nuevos registros
al cumplirse un año desde la última vez que los
realizamos. Estos nuevos registros comprenden además
el protocolo de mantenimiento expuesto anteriormente en las
visitas semestrales.
— Exploración radiológica al cumplirse un año
desde el último control radiológico.
• Rx. Periapicales en aquellos implantes comprometidos: espiras
expuestas, movilidad, sangrado, etc., con técnica de
paralelización.Esta técnica nos asegura que la
proyección es la misma y evita distorsiones que pueden
llevar al clínico a una lectura distinta a la situación
real de pérdida ósea o desajuste de la conexión
del implante con la prótesis (Figura 7).
• Rx. Panorámica. Nos da una visión global de
todas las estructuras óseas e implantarías pero
con una peor
definición, no muestra la angulación específica
de cada zona y tiene menos utilidad diagnóstica.
— Desmontaje de las prótesis removibles y barras para
su limpieza y pulido con puntas de ultrasonido convencionales
en las prótesis y de carbono en la barra, para evitar
el rayado de esta y pasta de baja abrasividad (Figura8).
Eliminación de los depósitos de cálculo
y placa bacteriana alrededor de los implantes con puntas de
ultrasonidos de carbono o curetas de plástico, oro o
carbono composite a baja intensidad y pulido con pasta de baja
abrasividad.
— En las prótesis cementadas, si conseguimos realizar
una profilaxis adecuada con las puntas de ultrasonido
o curetas de carbono con la ayuda de cepillos interproximales
o super floss sin desmontar la prótesis, ahorraremos
al paciente el desagradable trance de levantar la prótesis
con el martillo neumático, que se llevará a cabo
en caso de patología peri implantaria.
— En las prótesis atornilladas, debemos levantar el composite
y la gutapercha para apretar los tornillos con el torque adecuado,
y, posteriormente, sellar en la forma convencional, en el caso
de movilidad de la prótesis por aflojamiento de los tornillos
y patología perimplantaria (Figuras 9a y 9b).
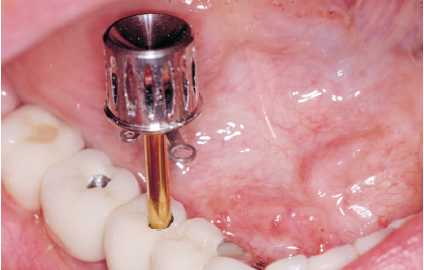
Figura 6. Ajuste con llave manual
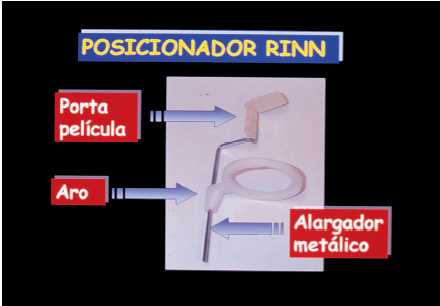
Figura 7. Posicionados de Rinn para técnica de paralelización

Figura 8. Barra desmontada para proceder a su limpieza y pulido
Figuras 9a y 9b. Relleno de gutapercha y composite de las chimeneas
PROTESIS
REMOVIBLES |
Limpieza
de prótesis 6 meses
Desmontar barra 12 meses
Eliminación cálculo y placa 6 meses
Pulido de superficies y barra 6 meses
Sondaje de posibles bolsas 6 meses
Estabilidad implantes 12 meses
Control radiográfico 12 meses
Comprobar oclusión 12 meses |
| PRÓTESIS
FIJAS |
CEMENTADAS |
Desmontaje
de prótesis.Ocasionalmente
Eliminación de cálculo y placa 6 meses
Pulido superficies 6 meses
Sondaje de posibles bolsas 6 meses
Estabilidad implantes 12 meses
Control radiográfico 12 meses
Comprobar oclusión 12 meses |
| ATORNILLADAS |
Desmontaje de prótesis Ocasionalmente
Eliminación cálculo y placa 6 meses
Pulido de superficies 6 meses
Sondaje de posibles bolsas 6 meses
Estabilidad implantes 12 meses
Control radiográfico12 meses
Comprobación del torque de los tornillos
transoclusales con llave
dinamométrica12 meses
Comprobar oclusión 12 meses |
Conclusiones
Un protocolo de mantenimiento en implantes basado en la educación
de las técnicas de higiene dental, motivación
y refuerzo llevado con rigurosidad y pautado en el tiempo e
instrumental con características especiales por parte
del profesional odontológico, determina el éxito
del tratamiento de implantes y la satisfacción de nuestros
pacientes (Figuras 10 y 11).
ENFERMEDAD PERIIMPLANTARIA
Con el término de enfermedades periimplantarias incluimos
un amplio abanico de patologías inflamatorias de
origen infeccioso que afectan a los tejidos que rodean a un
implante.
En el primer Workshop Europeo de Periodontología se
acuñaron denominaciones específicas para dos patologías
inflamatorias periimplantarias bien diferenciadas: "mucositis
periimplantaria" y "periimplantitis", que guardan
un paralelismo acentuado con las patologías periodontales:
gingivitis y periodontitis.
Actualmente, se tiende a mantener el nombre de mucositis periimplantaria,
y el de osteítis periimplantaria,
bien como dos entidades clínicas independientes, o como
el estadio previo uno de la otra, en tanto en cuanto la afección
de los tejidos periimplanta-rios se limite a los blandos (mucositis)
o ya trascienda al
óseo (periimplantitis u osteítis).
Fisiopatología de los tejidos periimplantarios
Los tejidos blandos que rodean a los implantes son muy semejantes
en su estructura y composición a los periodontales. El
tejido blando supracrestal que rodea a los implantes se denomina
MUCOSA PERIIMPLANTARIA y forma en torno al implante una estructura
llamada surco periimplantario que es semejante al surco gingival.
Este tejido está recubierto en su vertiente interna por
el epitelio del surco y un epitelio de unión, y en su
vertiente externa por un epitelio oral que puede ser queratinizado
o simple mucosa alveolar. Entre las células más
apicales del epitelio de unión y el hueso alveolar se
encuentra una zona de tejido conectivo que también entra
en contacto directo con la superficie del implante y que se
denomina lámina propia (Figura 12).
Epitelio del surco
Se trata de un epitelio poliestratificado similar al que encontramos
alrededor de un diente. Sin embargo, aunque alrededor de los
dientes siempre existe una mínima anchura de mucosa queratinizada
(0,5 mm) debido al potencial inductor del ligamento periodontal,
alrededor de los implantes es posible encontrar ausencia completa
de mucosa queratinizada, probablemente debido a la ausencia
de ese ligamento (Figura 13).
Epitelio de unión
El epitelio de unión al implante está formado
por células epiteliales, que están unidas entre
sí por desmosomas y éstas se unen a la superficie
del implante a través de hemidesmosomas y la lámina
basal.
Forma un sellado mucoso de unos 2 mm de altura.
Unión química entre las glucoproteínas
hemidesmosómicas y el óxido de titanio (Figura
14).

Figura 10. Paciente con excelente higiene y cuidados
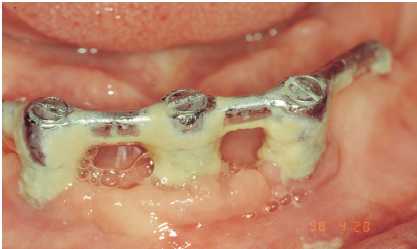
Figura 11. Paciente con pésima higiene y cuidados

Figura 12. Anatomía de la unión implantogingival
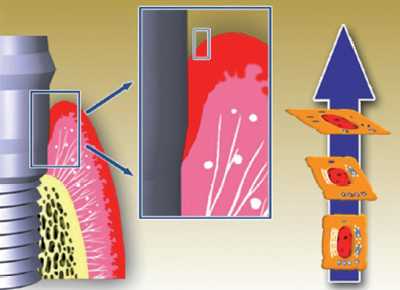
Figura 13. Epitelio del surco
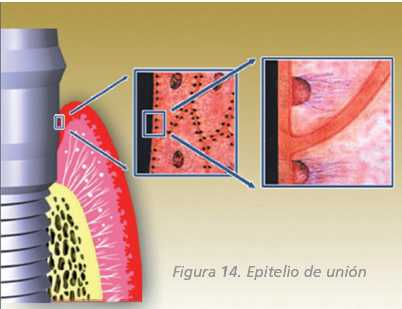
Figura 14. Epitelio de unión
Lámina propia
Se trata de una zona de tejido conectivo cicatricial formado
por una red tridimensional de fibroblastos (1-3 %), fibras colágenas
(85%) y vasos sanguíneos de 1,5 mm de altura. Las fibras
de colágeno tienen una orientación paralela a
la superficie de titanio y se disponen de forma circular, oblicua
o corono-apical creando un manguito fibroso periimplantario.
Se insertan sólo en el conectivo gingival y en el hueso
alveolar. Mayor proporción de colágeno tipo V
(Figura 15).
Etiología de las enfermedades peri-implantarias
Clásicamente, se han considerado dos factores etiológicos
como los responsables de la alteración de los tejidos
blandos que conduce a la pérdida del sellado mucoso y
a la invasión bacteriana del sustrato óseo: la
infección bacteriana y la sobrecarga oclusal.
Sin embargo, y dada la similitud de la respuesta fisiopatológica
de los tejidos periimplatarios, en los últimos tiempos
también se ha considerado otros factores como fundamentales
en la génesis de la enfermedad periimplantaria, como
son el estrés y el papel cada vez más importante
del tabaco, tanto por su efecto directo como por el papel que
juega como coadyuvante de la infección microbiana, por
los cambios que produce en la palca bacteriana
Infección bacteriana
Todo parece indicar que el factor etiológico principal
en el desarrollo de la enfermedad periimplantaria es la infección
por bacterias patógenas de la placa debido a la capacidad
que tienen de alterar la adhesión del epitelio de unión.
Esto se basa en que los tejidos blandos periodontales y periimplantarios
responden de igual forma ante la placa bacteriana, presentando
muchas características en común en cuanto a la
lesión inflamatoria y en que un cuidadoso control de
la placa bacteriana reduce la posibilidad de enfermar por
patologías implantares similares a lo que se observa
en las enfermedades periodontales. Sin embargo, cuando el depósito
de placa se prolonga en el tiempo, aunque ambos infiltrados
inflamatorios tienen muchas características comunes,
la extensión apical es más pronunciada en la mucosa
periimplantaria.
La colonización del surco periimplantario una vez que
el implante se comunica con el medio oral sigue un patrón
semejante al que tiene lugar en el surco periodontal tras
la erupción dentaria, por lo que la flora presente
en el entorno periodontal y periimplantario es similar tanto
en estados de salud como en presencia de patología.
Cuando no existe ningún tipo de patología
la flora está compuesta por cocos G (+), aerobios
(streptococcus) y bacilos inmóviles (actinomyces)
tanto en implantes como en dientes.
En situaciones patológicas la flora en ambos casos estará
compuesta por bacterias anaerobias G (-), aumentando el porcentaje
de bacilos móviles, fusiformes y espiroquetas (Prevotella
intermedia, Fusobacterium nucleatum, Porphyromona gingivalis,
Capnocytophaga, etc.).
Cuando las bolsas periimplantarias son profundas encontramos
una microflora con un incremento importante de la población
anaerobia donde los bacilos G (-) anaerobios móviles
(Prevotella intermedia, Fusobacterium, Porphyromona gingivalis,
etc.) representan más de la mitad de la flora.
La composición de la microflora periimplantaria es distinta
dependiendo de si el implante ha tenido o no episodios previos
de periimplantitis. La presencia de Porphyromona gingivalis
parece indicar la presencia previa de episodios de periimplantitis.
La presencia de niveles altos de Porphyromona gingivalis, Prevotella
intermedia y Actinobacillus actinomycetemcomitans en la bolsa
periimplantaria es indicativo de un mayor riesgo de pérdida
de inserción en la fase posterior de mantenimiento.
Sobrecarga biomecánica
Hay diversas evidencias clínicas que han llevado a varios
autores a correlacionar la pérdida ósea periimplantaria
con una magnitud de carga por encima del rango fisiológico.
En un implante que todavía no está sometido a
carga encontramos siempre un hueso periimplantar con disposición
horizontal. Cuando se establece la funcionalización de
ese implante la necesaria formación de una anchura biológica
adecuada provoca una discreta reabsorción ósea
periimplantaria en forma de cuña sin ningún tipo
de significado patológico.

Figura 15. Lámina propia
Si ese implante recibe una carga biomecánica excesiva
se van a provocar una serie de microfracturas en la interfase
hueso-implante a nivel coronal y consecuentemente una reabsorción
ósea. Esta reabsorción, que se produce de forma
adaptativa, se detiene cuando se establece un equilibrio mecánico
entre la carga aplicada y la resistencia del hueso periimplantar.
Al desaparecer la osteointegración en esa zona, se produce
una
proliferación apical del epitelio y tejido conjuntivo.
Esta migración crea las condiciones adecuadas para que
se produzca con mayor facilidad una infección bacteriana
marginal que puede propagarse de forma progresiva en profundidad
aumentando la destrucción ósea periimplantar (Figura
16).
Figura 16
Clasificación de las enfermedades periimplantarias
Así pues, la enfermedad periimplantaria, caracterizada
por la alteración infeccioso-inflamatoria de los
tejidos
periimplantarios, puede manifestarse de dos formas distintas:
A) Mucositis periimplantaria: forma reversible de afección
inflamatoria de los tejidos blandos que rodean a un implante
en función
(Figura 17).
B) Osteítis periimplantaria (Periimplantitis): forma
irreversible de afección inflamatoria de los tejidos
blandos y duros que rodean a un implante en función en
la que se produce pérdida ósea (Figura 18).
Mucositis periimplantaria
Se trata de una forma reversible de afección inflamatoria
de los tejidos blandos que rodean a un implante en
función.
Desde un punto de vista clínico, los signos principales
son:
• Presencia de placa bacteriana y cálculo.
• Edema, enrojecimiento e hiperplasia de la mucosa.
• Sangrado y compromiso del sellado mucoso al sondaje.
• En ocasiones exudado o supurado (microabsceso gingival).
• Ausencia radiológica de reabsorción ósea.
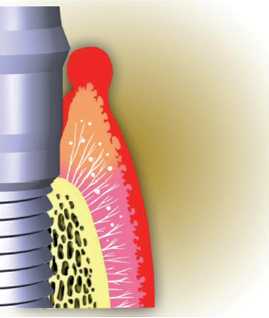
Figura 17. Mucositis periimplantaria

Figura 18. Osteítis periimplantaria(periimplantitis)
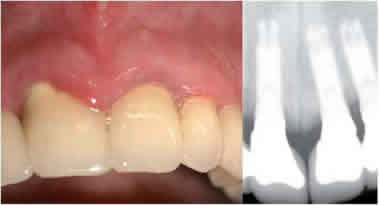
Figura 19. Mucositis periimplantaria
Osteitis periimplantaria (periimplantitis)
Se trata ya de una forma irreversible de afección
inflamatoria de los tejidos blandos y duros que rodean a
un implante en función, en la que se produce pérdida
ósea natural del proceso si no se aplica tratamiento
alguno.
Los signos clínicos derivados de esta situación
son los correspondientes a un grado de afectación más
profundo que la afección mucosa y se caracterizan por:
• Presencia de placa bacteriana y cálculo.
• Edema y enrojecimiento de los tejidos marginales.
• Hiperplasia mucosa en zonas donde no hay demasiada encía
queratinizada.
• Aumento de la profundidad del sondaje, estando el nivel de
detención de la sonda más apical.
• Sangrado y ligera supuración después del sondaje
y/o palpación.
• Destrucción ósea vertical en relación
con la bolsa periimplantaria.
• Presencia radiológica de reabsorción ósea.
• Movilidad del implante.
• El dolor no es muy frecuente, pero a veces se presenta.
Finalmente, la movilidad y radiolucidez periimplantaria continuas
indican que está próximo el desenlace
final de la enfermedad, caracterizado por una pérdida
total de la interfase hueso-implante.
Esadiaje y clasificación
De todos los intentos de clasificación de la enfermedad
periimplantaria, tal vez el más gráfico de todos
sea el de Jovanovic y Spiekermann, ya que permite también
una aproximación terapéutica y pronóstica.
Así, clasifican las periimplantitis en cuatro grados:
— Periimplantitis clase 1: destrucción
ósea horizontal mínima con ligera pérdida
ósea periimplantaria.
— Periimplantitis clase 2: destrucción
ósea moderada con pérdida vertical solitaria.
— Periimplantitis clase 3: destrucción
ósea horizontal moderada o intensa con extensa lisis
ósea circunferencial.
— Periimplantitis clase 4: destrucción
ósea horizontal intensa con extensa lisis ósea
circunferencial y pérdida de la pared ósea
lingual o vestibular
(Figuras 20 a 23.)
TRATAMIENTO DE LAS ENFERMEDADES PERIIMPLANTARIAS
Tratamiento de la mucositis periimplantaria
El tratamiento de la mucositis se basa en el control de la placa
bacteriana, como condición fundamental.
Clásicamente, se han agrupado en cuatro acciones, complementarias
entre ellas:
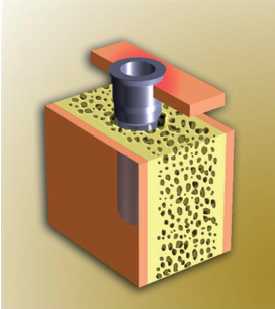
Figura 20. Periimplantitis grado 1 (adaptado de Spiekermann)
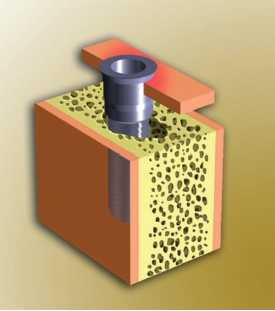
Figura 21. Periimplantitis grado 2 (adaptado de Spiekermann)
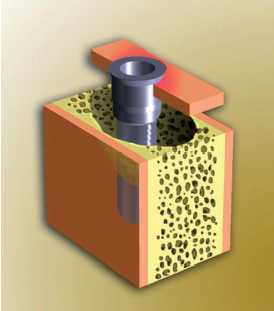
Figura 22. Periimplantitis grado 3 (adaptado de Spiekermann)
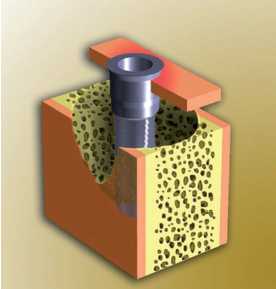
Figura 23. Periimplantitis grado 4 (adaptado de Spiekermann)
1. Higiene periimplantaria profesional
• Eliminación mecánica y/o química de la
placa bacteriana (Vector-Durr).
• Irrigación del surco-bolsa con clorhexidina al 0,12
por ciento.
• Desmontaje y desinfección de la prótesis y los
pilares.
• Modificación del diseño de prótesis poco
higiénicas.
• En ocasiones realización de un colgajo de espesor
parcial para irrigar con suero fisiológico estéril
y aplicar pomada de tetraciclina.
2. Higiene periimplantaria personal
• Control químico de la placa con clorhexidina al 0,12
por ciento cada 12 horas.
3. Antibióticos locales y sistémicos
4. Controles periódicos profesionales
Periimplantitis
La condición fundamental para el éxito en
el tratamiento de la periimplantitis, con o sin protocolos
de regeneración ósea, es la descontaminación
de la superficie del implante de bacterias y toxinas.
La base del tratamiento de la periimplantitis es la estabilización
de la pérdida ósea progresiva y, en algunos
casos, recuperar el hueso perdido con un tratamiento regenerativo.
El tratamiento, al igual que en las enfermedades periodontales,
se divide en dos fases:
1.ª fase. Tratamiento inicial conservador.
2.ª fase. Tratamiento regenerativo de los defectos óseos.
1.ª fase. Tratamiento inicial conservador
Esta fase va encaminada a corregir todo tipo de defectos
de ajuste de la prótesis y eliminar el depósito
de placa que hubiera sobre la superficie del implante. Para
ello se pueden emplear varios procedimientos:
A) Métodos manuales-mecánicos
• Copas de goma.
• Curetas de plástico.
• Fresas o ultrasonidos para pulir espiras expuestas.
• Sistemas de aire-polvo.
B) Métodos químicos
B.1. Locales
• Clorhexidina al 0,12 por ciento cada 12 horas. Utilizada en
enjuagues o intrasulcular para el control de la placa.
• Ácido cítrico pH 1-3.
• Pasta de tetraciclina.
B.2. Sistémicos
Se basa en la utilización de antibioterapia. Actualmente
la pauta adecuada es la de amoxicilina/ác.
clavulánico a dosis de 875-125 mg cada 8 horas o de 2.000-125
mg cada 12 horas.
C) Láser de diodos
Se basa en la utilización del láser de diodos.
El protocolo de utilización sería utilizar una
potencia de 1 W durante 20 segundos.
2ª fase. Tratamiento regenerativo de los defectos
óseos
Es posterior a la 1.ª fase, y se aplica cuando los
fenómenos inflamatorios gingivales han desaparecido,
y el control de placa es correcto.
En esta fase la terapia incluye el tratamiento de los tejidos
blandos, el de la superficie del implante y el
de los defectos óseos.
1. Tratamiento de los tejidos blandos
Haremos una incisión
crestal festoneando el cuello del implante y
eliminaremos el epitelio interno de la bolsa y el tejido de
granulación.
Levantamos un colgajo mucoperióstico exponiendo implante
y tejido óseo y procedemos a eliminar el tejido de granulación
que hay en el defecto óseo.
2. Tratamiento de la superficie del implante
En la zona de espiras del implante que vaya a quedar expuesta
realizaremos una implantoplastia, para
conseguir una superficie lisa y pulida que facilite el mantenimiento
en salud de los tejidos periimplantarios.
Finalmente irrigamos el campo operatorio con clorhexidina y
suero fisiológico.
3. Tratamiento de los defectos óseos
El tratamiento de los defectos óseos ocasionados por
la osteítis periimplantaria resulta difícil de
protocolizar porque en muchas ocasiones la decisión se
toma de forma intraoperatoria, una vez visualizada la magnitud
real de la pérdida.
Desde el punto de vista didáctico, y según la
Clasificación de Jovanovic y Spiekermann, podemos protocolizarlo
de la siguiente manera:
I. Periimplantitis grado 1
Realizaremos una reducción quirúrgica de la profundidad
de las bolsas adelgazando los colgajos mucosos y reposicionándolos
apicalmente hasta el nivel del borde óseo mediante la
técnica de sutura correspondiente. La superficie del
implante se limpia y detoxica y sólo realizaremos una
implantoplastia cuando queden espiras
expuestas.
II. Periimplantitis grado 2
Similar al grado 1, pero la reposición se realiza
más hacia apical, dejando una superficie implantaria
expuesta mayor y por ello haremos una implantoplastia.
Si la reabsorción vertical localizada tiene tres o más
paredes, regeneramos ese defecto óseo con las técnicas
clásicas de RTG. En los casos donde el defecto sea de
una o dos paredes, realizaremos osteoplastia o nivelación
ósea para favorecer un reposicionamiento de los tejidos
blandos que satisfaga criterios de autolimpieza.
III. Periimplantitis grado 3 y 4
En ambos grados de periimplantitis la presencia de defectos
verticales permite realizar técnicas de RTG casi
siempre aunque la técnica a emplear dependerá
de la morfología y del número de paredes del defecto.
Podemos realizar las siguientes combinaciones, y la elección
de una u otra dependerá del hallazgo intraoperatorio:
• Osteoplastia + implantoplastia + reposición apical
del colgajo.
• RTG cerrada + injerto + reposición coronal del colgajo.
• RTG semiabierta o transgingival + implantoplastia + reposición
apical del colgajo.
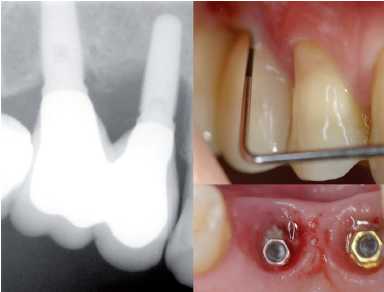
Figura 24. Periimplantitis grado 4. Exploración y radiografía
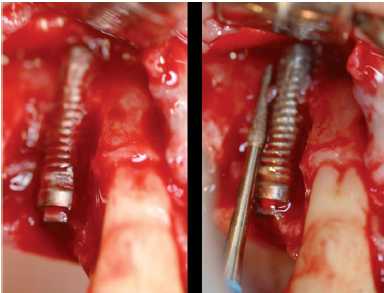
Figura 25. Elevación de colgajo e implantoplastia
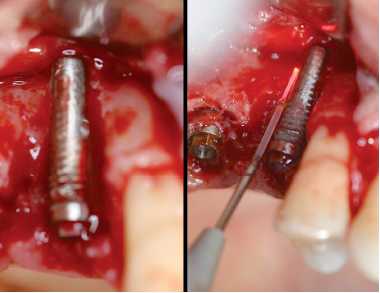
Figura 26. Descontaminación de superficie con láser de diodo
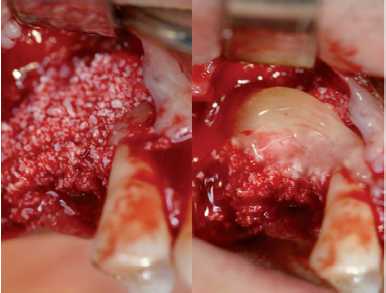
Figura 27. Injerto óseo: hidroxiapatita y PRGF
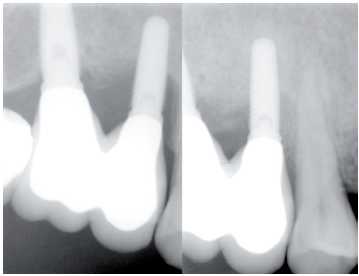
Figura 28. Radiografía preoperatoria y postoperatoria a los 3 meses
BIBLIOGRAFÍA
Thomas F. Flemmig. "Compendio de periodoncia".
Ed. Masson 1995
Woodall, Dafoe, Stutsman Young, Leed-Fonner, Yankell.
"Tratado de higiene dental I y II". Ed. Salvat
1992.
A. Sicilia,B. Noguerol M. E. Rodriguez Rosell.
"Periimplantología". Periodoncia vol. 4
nº 1. Enero-abril 1994
P. J. Buitrago Vera, F. J Gil Loscos, F. J. Enrile
de Rojas "Mantenimiento en implantes por el
Higienista dental". Periodoncia. Vol 11. nº5.
Octubre-Diciembre 2001.
Calvo Rocha C. "La higiene bucal
en implantologia". Gaceta dental nº 83,Dic 97
Ortega, JJ; Bowen A. Patología
periimplantaria. Gaceta Dental. 148: 110- 135. Febrero 2002
Albrektsson T, Isidor F. Consensus report
of session IV. In: Lang,
N. P. & Karring T., eds. Proceedings
of the 1º European Workshop on Periodontology. 1994,
365-369. London, Berlin: Quintessence Publishing Company.
Exposito M, Hirsch J, Lekholm U, Thomsen P.
Differential diagnosis and treatment strategies for biologic
complications and failing oval implants. A review of the
literature. International Journal of Oral and Maxillofacial
Implants 1999; 14: 473-490.
Tonetti MS. Risk factors for osseodisintegration.
Periodontology 2000. 1998; 17: 55-62.
Newman MG, Flemmig Th F. Bacteria-host
interactions. En: Advanced Osseointegration Surgery. Applications
in the Maxillofacial Region. De Whorthington Ph y Brånemark
P I. Quintessence. Chicago 1992; pp: 67-79.
Newmann MG, Flemmig TF. Periodontal considerations
of implants and implant associated microbiota. Journal Dental
Education 1988; 52: 737-744.
Berglundh T, Lindhe J, Marinello CP, Ericsson I,
Liljenberg B. Soft tissue reaction to the new plaque
formation on implants ant teeth. An experimental study in
the dog. Clinical Oral Implants Research 1992; 3: 1-8.
Lindhe J, Nyman S. Occlusal therapy. In:
Lindhe J (ed). Textbook of clinical periodontology. 2ª
edition. Munksgaard, Coopenhagen (Denmark), 1989.
Ericcson I, Berglundh T, Marinello CP, Lindhe J,
Klinge B. Different types of inflammatory reactions
in pery-implant soft tissues.
Journal of Periodontology 1995; 22: 255-261.
Ericsson I, Berglundh T, Marinello CP, Liljenberg
B, Lindhe J. Long-standing plaque and gingivitis
at implants and teeth in the dog. Clinical Oral Implants
Research 1992; 3: 99- 103.
Apse P, Ellen R., Overall CM, Zarb GA.
Microbiota and crevicular fluid collagenase activity in
the osseointegrated dental implant sulcus: A comparison
of sites in edentulous and partially edentulous patients.
Journal of Periodontal Research 1989; 24: 96-105.
Adell R, Lekholm U, Rockler B, Brånemark
PI, Lindhe J, Eriksson B, Sbordone L. Marginal
tissue reactions at osseointegrated titanium fixtures (I).
A 3-year longitudinal prospective study. International Journal
Oral Maxillofacial Surgery 1986; 15: 39-52.
Mombelli A, Lang NP. Antimicrobial treatment
of peri-implant infections. Clinical Oral Implants Research
1992; 3: 149-155.
Listgarten MA, Hellen L. Relative distribution
of bacteria at clinically healthy and periodontally diseased
sites in humans. Journal of Clinical Periodontology 1978; 5: 115-132.
Mombelli A, Van Oosten MAC, Schurch E, Lang NP.
The microbiota associated with successful or failing osseointegrated
titanium implants. Oral Microbiology and Inmunology 1987;
2: 145-151.
Rosemberg Es, Torosian JP, Slots J. Microbial
differences in 2 clinically distinct types of failures of
osseointegrated implants. Clinical Oral Implants Research
1991; 2: 135-144.
Alcoforado GAP, Rams TE, Feik D, Slots J.
Aspects bactériologiques des échecs des implants
dentaires ostéointégrés chez l´homme.
Journal of Parodontologie 1991; 10: 11.
Rutar A, Lang NP, Buser D, Bürgin W. &
Mombelli, A. Retrospective assessment of clinical
and microbiological factors affecting periimplant tissue
conditions. Clinical Oral Implants Research. 2001; 12: 189-195
Slots J, Bragd L, Wikstrom M, Dahlén G.
The occurrence of Actinobacillus actinomycetemcomitans,
Bacteroides gingivalis and Bacteroides intermedius in destructive
periodontal disease in adults. Journal of Clinical Periodontology
1986; 13: 570.
Wolf LF, Lilhemark WF, Pihlstrom BL, Schaffer EM,
Aeppli DM, Bandt CL. Dark-pigmented Bacteroides
species in subgingival plaque of adult patients on a rigorous
recall program. Journal of Periodontal Research 1988; 23:
170.
Lindquist LW, Rockler B, Carlsson GE.
Bone resorption around fixture in edentulous patients treated
with mandibular fixed tissue-integrated prosthesis. Journal
of Prosthetic Dentistry 1988; 59: 59-63.
Ahlqvist J, Borg K, Gunne J, Nilsson H, Olsson
M, Åstrand P. Osseointegrated implants in
edentulous jaws. A 2-year longitudinal study. International
Journal Oral and Maxillofacial Implants 1990; 5: 155-163.
Naert I. The influence of the prosthetic
design and the implant type on the tissue reaction around
oral implants. Acta Biomedica Lovaniensia, University Press,
Leuven, Belgium, 1991.
Quirynen M, Naert I, Van Steenberghe D.
Fixture design and overload influence marginal bone loss
and fixture success in the Brånemark system. Clinical
Oral Implants Research 1992; 3: 104-111.
Spiekermann H. Implantologie. Georg Thieme-Verlag.
Stuttgart (Germany), 1994.
Tonetti MS, Schmid J. Pathogenesis of
implant failures. Periodontology 2000 1994; 4: 127-138.
Mombelli A, Lang NP. Antimicrobial treatment
of periimplant infections. Clinical Oral Implants Research
1992; 3: 149-155.
Bach G, Neckel C, Mall C, Krekeler G.
Conventional versus laser-assisted therapy of periimplantitis:
a five-year comparative study. Implant Dentistry 2000; 9:
247-251.



